TIN TỨC - SỰ KIỆN
Phương Pháp Chuẩn Độ Cl–, Br– và CN–
Thứ năm, 05/06/2025, 09:47
Chuẩn độ Cl–, Br– và CN–
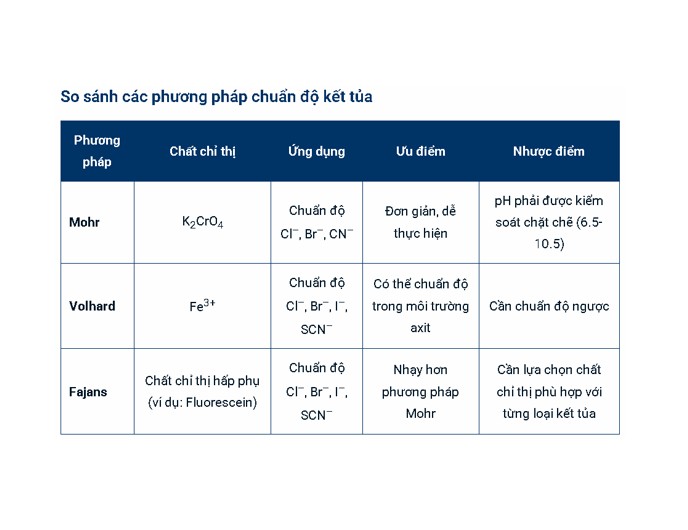
Để chuẩn độ Cl–, Br– và CN– thì có 2 phương pháp là : Phương pháp Mohr & Phương pháp Volhard.
- Phương pháp Mohr: Sử dụng chất chỉ thị cromat (K2CrO4) để xác định điểm cuối của chuẩn độ. Khi tất cả Cl– đã phản ứng với Ag+, lượng Ag+ dư sẽ phản ứng với CrO42- tạo thành kết tủa Ag2CrO4 màu đỏ gạch, báo hiệu điểm cuối chuẩn độ. Phương pháp này thường được sử dụng để chuẩn độ Cl–, Br– và CN– trong môi trường trung tính hoặc kiềm yếu. Lưu ý, pH quá kiềm sẽ tạo thành AgOH, còn pH quá axit sẽ làm cromat chuyển thành dicromat.
->Phương pháp Mohr: Sử dụng chỉ thị Kali Cromat (K2CrO4), máy sẽ phát hiện điểm cuối dựa trên sự thay đổi màu sắc rõ rệt khi tạo thành kết tủa Ag2CrO4 đỏ gạch.
- Phương pháp Volhard: Đây là phương pháp chuẩn độ ngược. Một lượng dư AgNO3 được thêm vào dung dịch chứa ion halogenua. Lượng Ag+ dư sau phản ứng được chuẩn độ bằng dung dịch thiocyanat (SCN–) với chất chỉ thị sắt(III) (Fe3+). Khi tất cả Ag+ dư đã phản ứng với SCN–, Fe3+ sẽ phản ứng với SCN– dư tạo thành phức chất FeSCN2+ màu đỏ máu, báo hiệu điểm cuối chuẩn độ. Phương pháp này có thể được sử dụng để chuẩn độ Cl–, Br–, I– trong môi trường axit.
Ví dụ về tính toán trong chuẩn độ kết tủa (Phương pháp Mohr)
Giả sử ta chuẩn độ 25.00 mL dung dịch NaCl bằng dung dịch AgNO3 0.1000 M, sử dụng K2CrO4 làm chất chỉ thị. Thể tích AgNO3 tiêu tốn là 20.00 mL. Tính nồng độ mol của NaCl.
Phản ứng chuẩn độ: Ag+ + Cl– → AgCl(s)
Số mol AgNO3 = 0.1000 M × 0.02000 L = 0.002000 mol
Theo phương trình phản ứng, tỉ lệ mol giữa Ag+ và Cl– là 1:1. Do đó, số mol NaCl cũng là 0.002000 mol.
Nồng độ mol của NaCl = (0.002000 mol) / (0.02500 L) = 0.0800 M